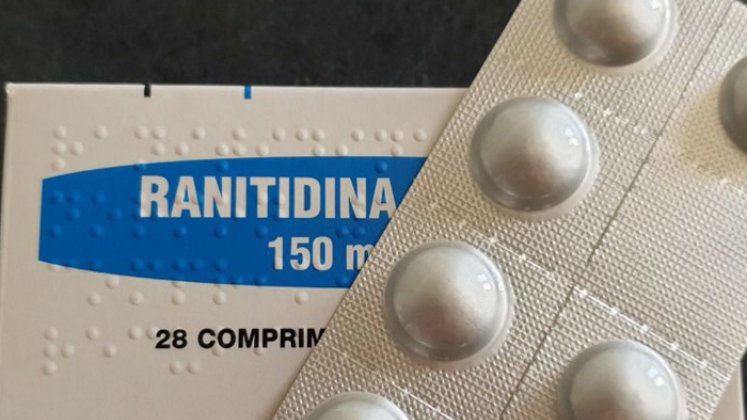
El Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima) ordenó el retiro preventivo de todos los lotes de los medicamentos con principio activo de Ranitidina para las presentaciones orales, debido al posible riesgo de contener una sustancia cancerígena.
Según el Invima, existe el riesgo de presencia de niveles inaceptables de la Nitrosamina nitrosodimetilamina (NDMA) en el producto, las cuales están clasificadas por la Agencia Internacional de Investigación del Cáncer (Iarc), como “probablemente carcinogénica” (categoría 2).
Esta sustancia puede encontrarse también en el humo del tabaco, algunos alimentos procesados y ciertos artículos de aseo, entre otros; por lo que el instituto recomendó el uso de otros productos de venta libre aprobados para el tratamiento de la ulcera gástrica o duodenal.
“Si usted consume el medicamento Ranitidina en cualquiera de sus presentaciones orales debe considerar el uso de otros productos de venta libre aprobados para esas indicaciones. La población en tratamiento con Ranitidina debe acudir a su médico para cambiarla por un tratamiento alternativo”.
El Invima también señaló que, si ha presentado algún evento adverso asociado al consumo de este producto, debe reportarlo a través del sitio web del Invima en ‘Medicamentos y productos biológicos’ - ‘reporte de eventos adversos para pacientes’.
Entre las medidas que recomendó para las secretarías de salud departamentales, distritales y municipales, el Invima solicitó hacer inspección, vigilancia y control a los establecimientos de su competencia, donde se podría comercializar el producto.
A las IPS y profesionales de la salud les recomendó abstenerse de comercializar y utilizar este producto, y en el evento de encontrar existencias, poner en cuarentena el producto e informar a la secretaría de salud.
“El Invima solicita que desde los programas institucionales de Farmacovigilancia se realice la búsqueda activa que garantice la detección de reacciones adversas donde se involucren medicamentos que contengan como principio activo Ranitidina en todas las presentaciones orales y sean reportados al Programa Nacional de Farmacovigilancia de Invima los eventos adversos asociados”, señaló.

















